7 月 30 日,NMPA批准恒润达生申报的雷尼基奥仑赛注射液(商品名:恒凯莱®)上市,用于治疗经过二线或以上系统性治疗后成人复发或难治性大B细胞淋巴瘤,包括弥漫性大B细胞淋巴瘤非特指型、滤泡性淋巴瘤转化的弥漫性大B细胞淋巴瘤、伴MYC和BCL2重排的高级别B细胞淋巴瘤、高级别B细胞淋巴瘤非特指型[1]。恒凯莱®是一款靶向CD19 CAR-T产品,其从研发到生产实现了全流程国产化,打破国外技术垄断,标志着中国免疫细胞治疗技术迈入自主可控的全新阶段,为更多亟待满足的临床需求提供了解决方案[2]。
近岸蛋白提供符合CAR-T研发和生产需求的一系列GMP产品,包括GMP级重组CD3抗体/CD28抗体、GMP级CD3/CD28 beads、GMP级mRNA原料酶、GMP Cas9/AaCas12bMax/enCas12hf/enCas12Ultra蛋白、GMP级全能核酸酶、GMP级细胞因子(如IL-2/IL-7/IL-15)等。此外,近岸蛋白还提供多种类型的CAR-T阳性率检测试剂盒和靶点抗原,可用于CAR-T阳性率检测。
CAR-T细胞治疗生产全流程
CAR-T细胞治疗全流程,包括采集病患或者健康供体的外周血单核细胞(PBMC)、T细胞分离激活,T细胞体外基因修饰,CAR-T细胞体外扩增,CAR-T细胞质量监控,CAR-T细胞回输病患体内这六个主要步骤。
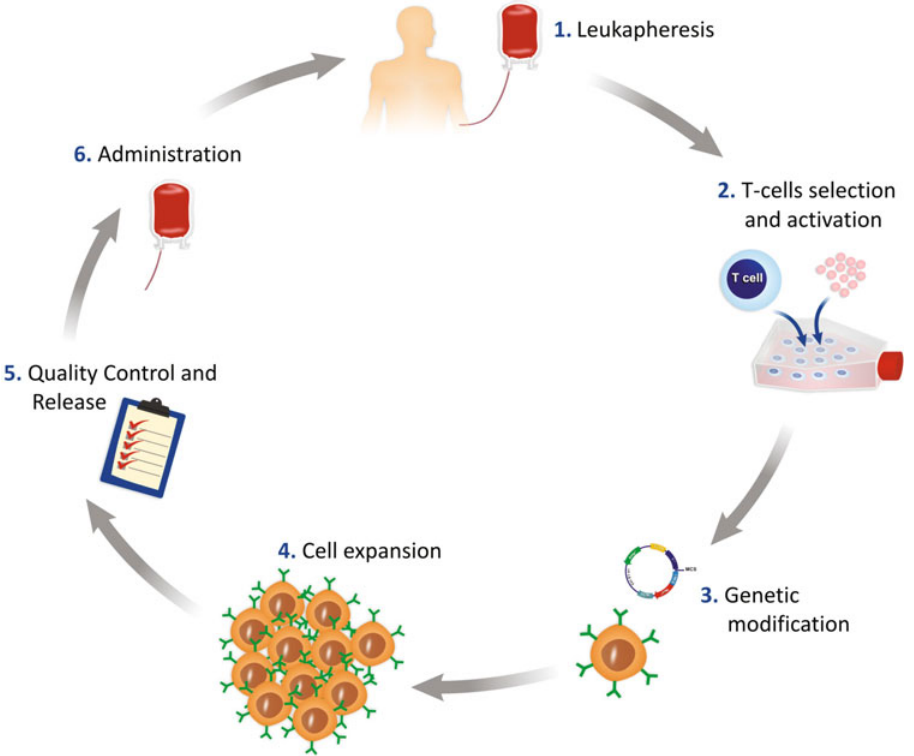
图1 CAR-T细胞治疗工作流程的示意图[3]
壹 采集病患或者健康供体的外周血单核细胞(PBMC)
采集病患或健康供体的外周血单核细胞(PBMC)是CAR-T生产过程中的关键步骤之一。供体选择时,病患供体需考虑其身体状况及免疫细胞数量是否足够。健康供体需经过严格的健康筛查,确保无传染病风险。注意操作规范和质量控制,并符合伦理与法律规定。
贰 CAR-T细胞的分离、激活
CAR-T细胞的产生始于通过单采或外周静脉血收集患者的外周血单核细胞(PBMC)。由于PBMC的组成差异很大,为保证尽量获得一致的CART细胞,需要利用基于磁珠的技术分离出特定的T细胞亚群,如CD4+、CD8+、CD62L+或CD45RO+ T细胞。
许多研究表明,T细胞亚群的选择是CAR-T细胞治疗效果的基础。在这方面,中央记忆T细胞(TCM)的CAR转导似乎对体内有效的细胞扩张、存活和持久性至关重要[4]。此外,选择幼稚或分化程度较低的CD8+T细胞进行转导可以使输注后T细胞增殖和体内持久性增加。
无论是否采用了T细胞分离过程,都需要T细胞活化步骤来进行充分的转导和扩增。为了实现这一目标,使用抗CD3和CD28抗体或固定化的CD3和CD28抗体刺激激活T细胞。固定化的抗CD3抗体提供更好的T细胞交联和活化,而CD28抗体可激活靶细胞中的共刺激信号通路。
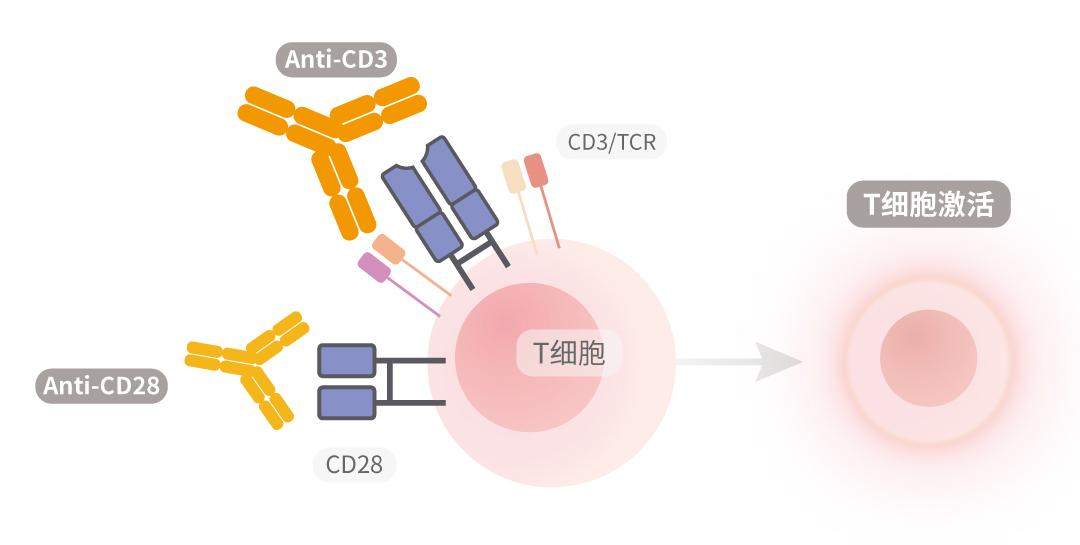
图2 抗CD3/CD28抗体激活T细胞原理示意图
CD3/CD28抗体偶联磁珠凭借其高效性和稳定性,成为行业主流选择。磁珠表面偶联抗CD3和CD28抗体,分别结合TCR/CD3和CD28受体,提供初级和共刺激信号,模拟天然APC的激活机制,并且通过磁场分离磁珠,避免传统APC培养的复杂性,且无饲养层细胞需求,为临床申报提供极大便利性。
01 anti-Human CD3 mAb和anti-Human CD28 mAb
近岸蛋白GMP级别的重组人源化anti-Human CD3 mAb(Cat. No.:GMP-A018),是在OKT3的基础上经过人源化改造,在保持了OKT3单抗对T细胞激活能力的前提下,很大程度上消除了鼠源性抗体的免疫原性,能够满足大多数T细胞扩增要求,对于难以扩增的细胞可以联合使用GMP级的重组人源化anti-Human CD28 mAb(Cat.No.:GMP-A063),实现安全高效的T细胞活化与增殖。
02 GMP级CD3/CD28磁珠
近岸蛋白为CGT客户提供GMP级CD3/CD28 beads(Cat. No.:GMP-B016),选用直径为 4.5μm的无孔单分散超顺磁性微珠,易于磁化和退磁,操作简便易去除,确保无磁残留风险;Anti-CD3抗体是通过成品药 OKT3 人源化改造而成,靶向 CD3ε;Anti-CD28抗体可以激活 T 细胞共刺激分子 CD28。
产品特点:
-
14天扩增倍数达1000倍以上
-
4.5μm超顺磁性微珠,有效避免结团
-
偶联的抗体为人源化抗体,均经过细胞库检定和病毒清除验证
-
低内毒素,小于0.5 EU/mL
-
GMP级别,高批间一致性
产品数据
(1)激活后细胞扩增情况
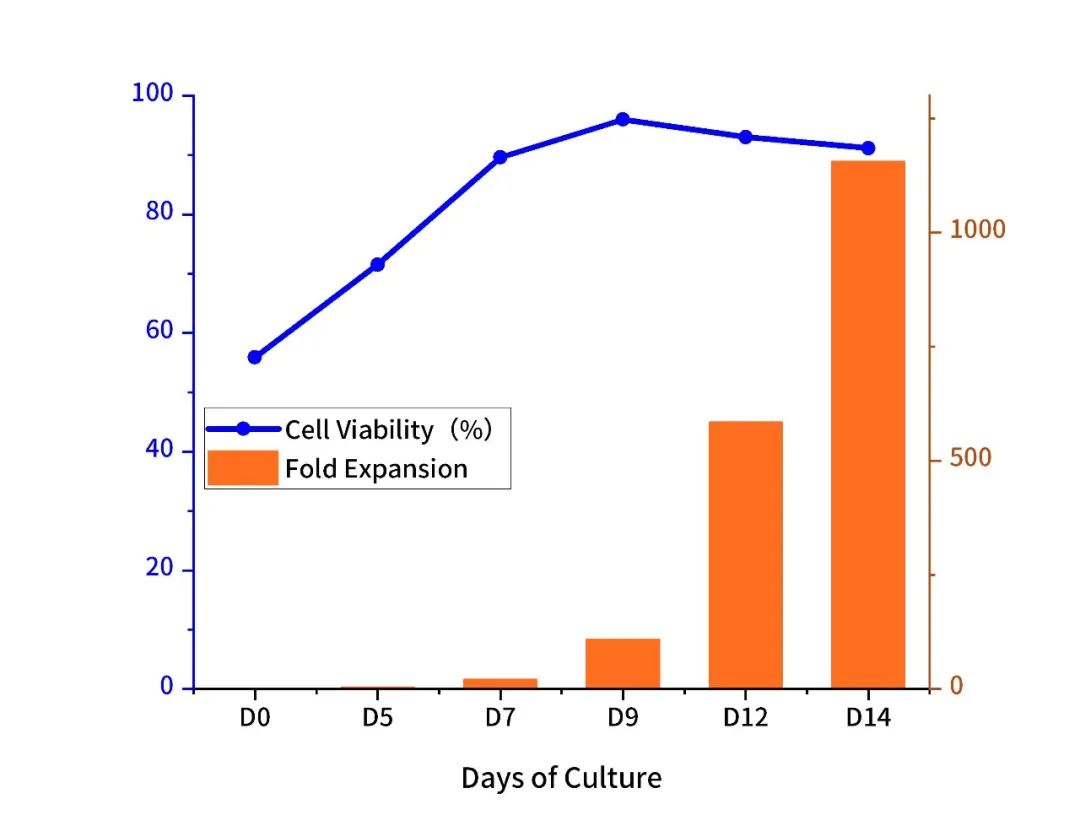
Expansion of the human PBMCs. Cells were stimulated with Anti- Human CD3/CD28 Beads (Cat. No. :GMP-B016) , and expanded for 14 days.
(2)激活第5天,细胞活化增殖占比99%以上
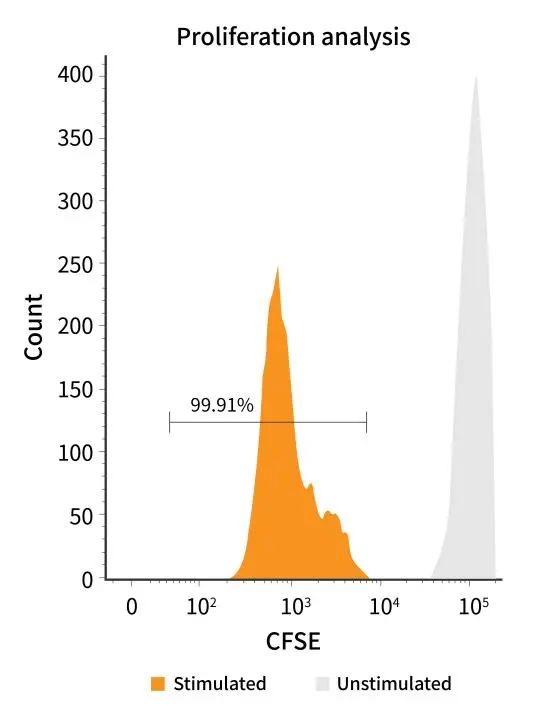
The human PBMCs were labeled with CFSE and stimulated with Anti- Human CD3/CD28 Beads, and then the proliferation of cells was assessed with CFSE dilution assay by flow Cytometry on day 5 after stimulation.
(3)激活后PD-1表达情况
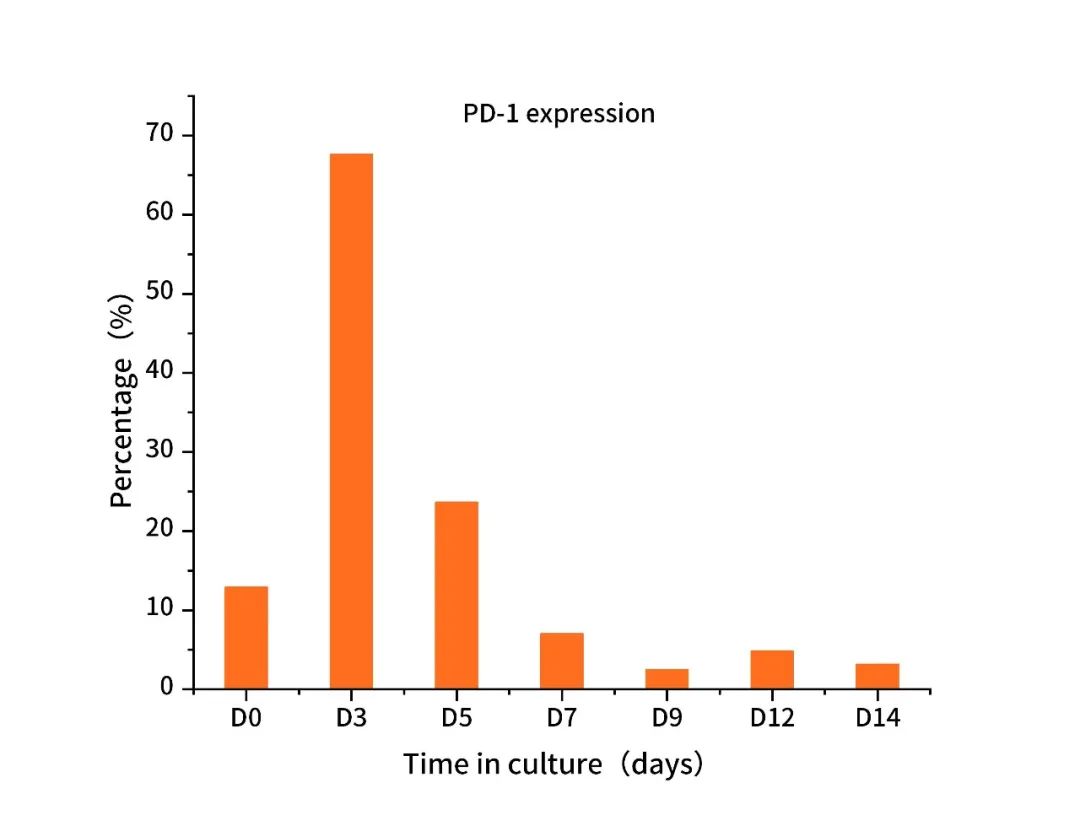
PD-1 expression of the activated human T Cells. The human T cells were stimulated with Anti- Human CD3/CD28 Beads (Cat. No.: GMP-B016), and expanded for 14 days.
叁 T细胞改造
01 T细胞基因修饰方法
A.mRNA用于T细胞的基因修饰:
近几年,mRNA技术快速发展,除了在传染病疫苗领域快速发展,在肿瘤治疗领域也逐渐凸显出其优势。通过体外转录修饰获得的转座子及CRISPR/Cas9系统等mRNA,已被成功用于T细胞基因编辑。
近岸蛋白提供全套mRNA体外转录及修饰用酶及试剂,产品符合GMP级生产及质量管理体系,已助力多家企业mRNA疫苗进入临床阶段。所有酶产品通过FDA DMF备案,为客户中美双报打下基础。除酶原料产品外,近岸蛋白还提供自序列设计到LNP包封的高通量筛选CRO服务,为初建mRNA技术平台的客户提供快速解决方案。
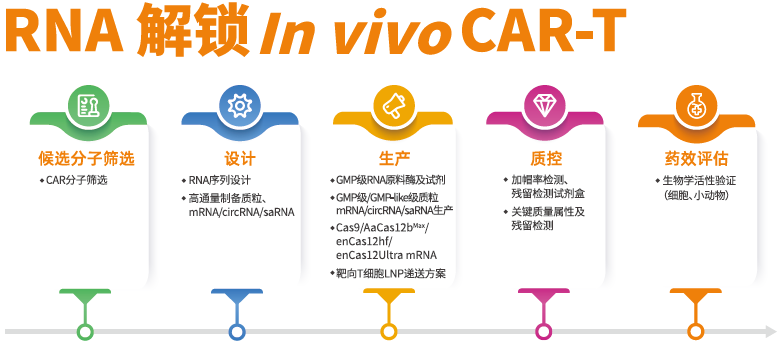
图3 近岸蛋白RNA原料及服务助力解锁体内CAR-T新疗法
B.CRISPR技术用于T细胞的基因修饰
利用CRISPR系统同时破坏多个基因位点,产生的TCR(T cell receptor)和HLA-I(HLA class I)缺陷的CAR-T细胞可以减少移植物抗宿主病(GVHD)和免疫排斥反应的发生,在开发通用型CAR-T细胞中已被广泛应用。CRISPR/Cas9敲除αβ T细胞内源性的TCR制备的通用型CAR-T细胞在临床前已经取得了很好的治疗效果[5] 。除了产生通用的CAR-T细胞,CRISPR技术也可以通过敲除编码信号分子的基因如PD1和CTLA4或编码T细胞抑制性受体的基因来提高CAR-T细胞的功能。
近岸蛋白可以提供GMP级的Cas9/AaCas12bMax/enCas12hf/enCas12Ultra蛋白,满足不同应用场景的基因编辑需求。
产品特点:
-
无重金属残留,无抗性残留
-
无菌、无抗生素、无病原体、无支原体
-
高纯度、高活性(体内外双重验证)
-
内毒素低于10EU/mg、宿主蛋白残留低于0.005%、外源性DNA残留低于100pg/mg
-
高稳定性和批间一致性
-
GMP厂房生产、药典标准放行检测
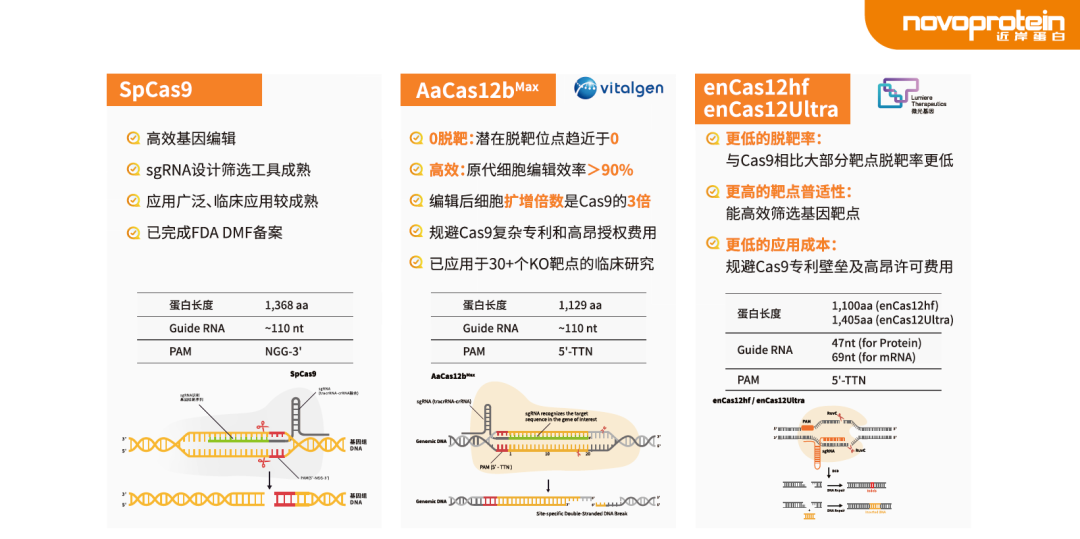 图4 不同类型Cas蛋白多维度解决基因编辑难题
图4 不同类型Cas蛋白多维度解决基因编辑难题
02 病毒载体的大规模生产
目前已有几种成熟的基因转移平台,可用于将嵌合抗原受体(CAR)基因引入原代T细胞。转基因插入可以通过病毒介导的转导、mRNA转染,睡美人转座子、piggyBac转座子或质粒DNA的非病毒转染来进行。在临床基因转移应用中,病毒载体是在靶细胞中实现感兴趣基因稳定表达或基因表达突变的主要手段。
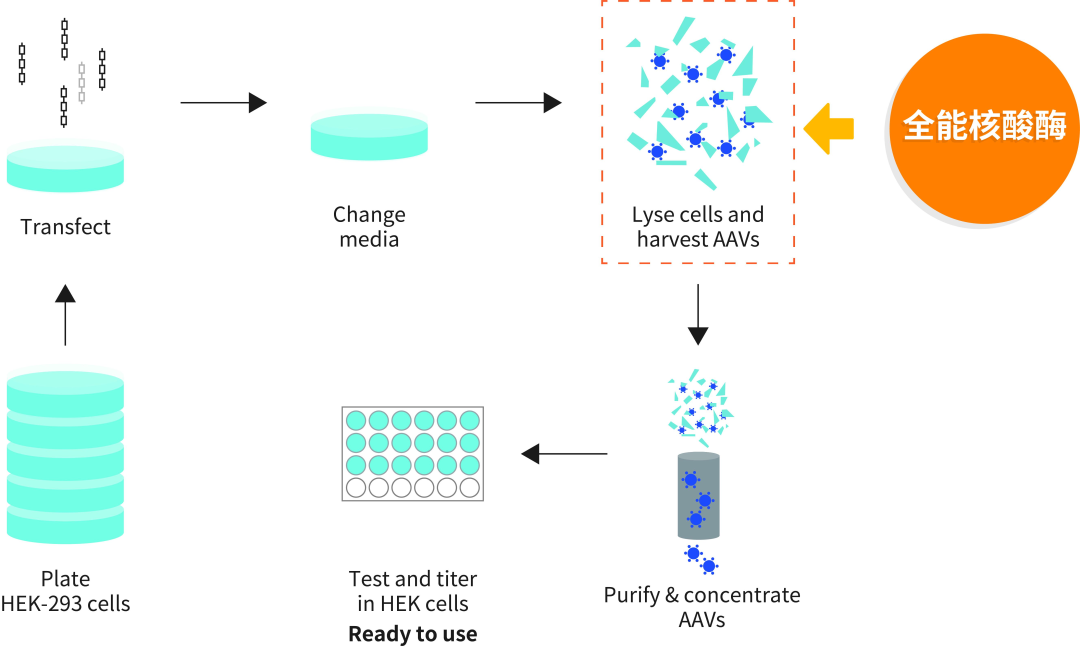
图5 rAAV病毒载体生产流程示意图[6]
在病毒载体的大规模生产纯化过程中,核酸残留成为各类质控标准的重中之重,因为DNA较好的稳定性,容易在生产过程中形成残留,而最终的生物制品应用到人类疾病预防和治疗时,会带来不可控的危险因素。对于病毒载体在生产过程中产生的核酸,现在大多选择核酸酶进行去除。
近岸蛋白质提供GMP条件下生产的全能核酸酶(BenzoNuclease),无动物源性,无氨苄青霉素,可高效降解单链、双链、线性、环状、超螺旋等任何形式的DNA及RNA。质量、性能、供货能力可靠,并已完成FDA DMF备案,可以满足药物申报的规范。同时提供高性能配套全能核酸酶残留检测试剂盒(检测范围0.014-10ng/ml),灵敏度高。

肆 CAR-T细胞扩增
不管是原代T细胞还是通过基因修饰获得的CAR-T细胞,都需要进行大规模的体外扩增,才能获得达到后续环节以及治疗所需剂量。
01GMP级细胞因子IL-2/IL-7/IL-15
已有大量文献指出,细胞因子IL-2/IL-7/IL-15在T细胞增殖、T细胞亚群的生长以及提高CAR-T产品疗效和持久性方面发挥重要作用。
Hopkins B等人进行了一项实验设计,研究不同组合IL-2、IL-7、IL-15对T细胞亚群生长的影响。结果表明,CD4+和CD8+ naïve T细胞分别在中等浓度的IL-2和IL-7组合以及IL-7作用下可以有效生长。CD4+和CD8+记忆细胞分别在中等浓度IL-2和IL-15组合以及中等浓度IL-7和IL-15组合中有利[5]。Coppola C等研究结果表明IL-2和IL-7在促进活化的CD4+ T细胞的最佳增殖和存活方面存在协同作用[7]。
近岸蛋白提供GMP级IL-2/IL-7/IL-15细胞因子产品,且已通过FDA DMF备案。如果您使用了近岸蛋白的DMF备案系列产品并需要引用DMF编号,点击下方按钮提出授权申请,我们收到申请后,将向FDA提供DMF授权书。
产品数据展示(以GMP-CD47,Recombinant human IL-7为例):
(1)活性数据
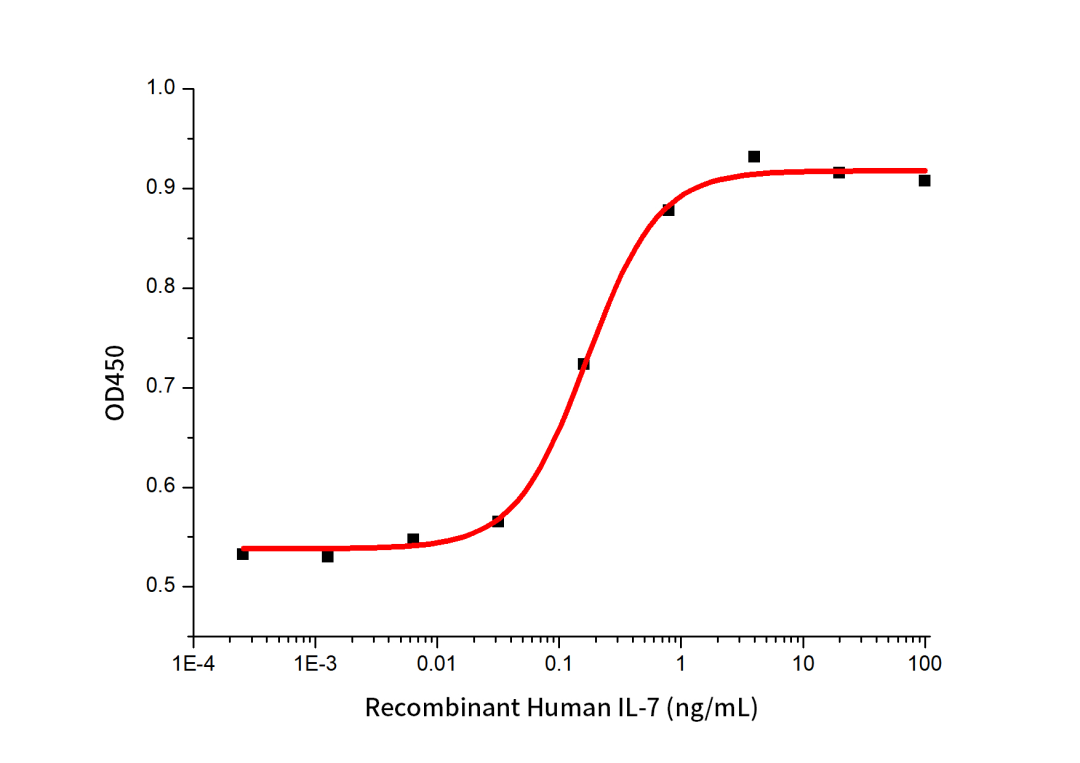
Measured in a cell proliferation assay using PHA-activated human peripheral blood lymphocytes (PBL). The ED50 for this effect is 168.10 pg/ml.The specific activity of Recombinant human IL-7 is > 1.0 × 108 IU/mg, which is calibrated against human IL-7 WHO International Standard (NIBSC code: 90/530)
(2)批间稳定性数据
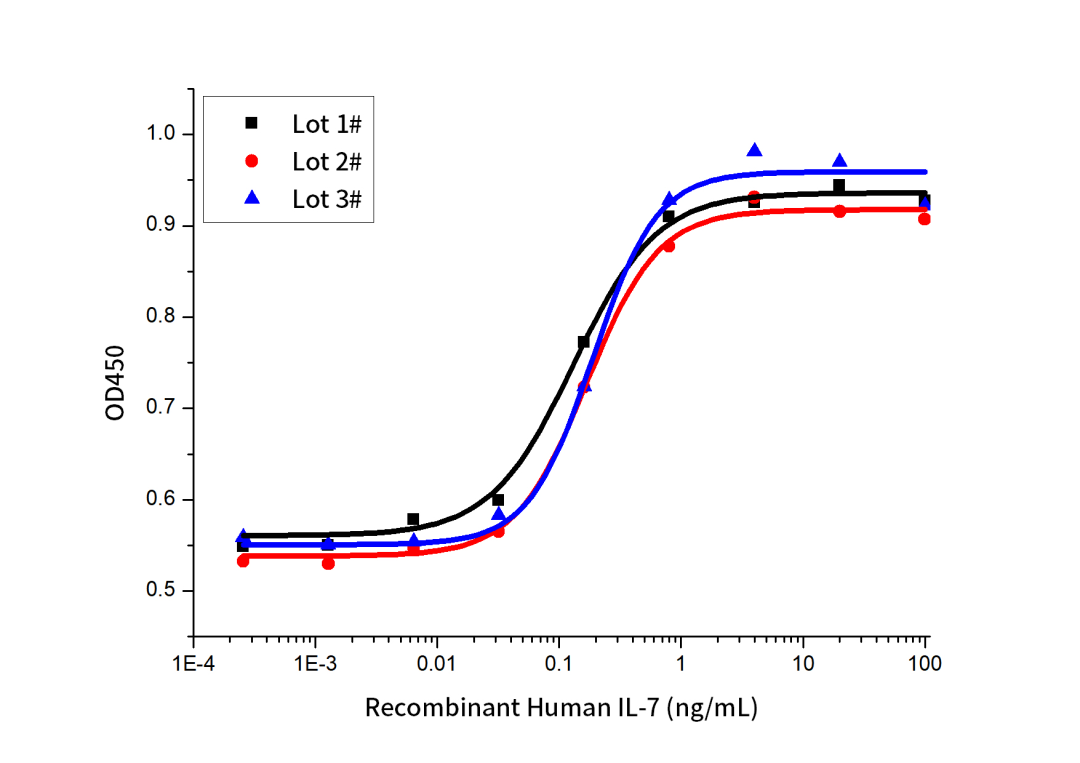
Three independent lots were tested for activity and plotted on the same graph to show lot-to-lot consistency of IL-7.
伍 CAR-T细胞质量监控
目前,细胞治疗产品的质量控制分为四个大的方面,分别为安全性、纯度、效力以及均一性,这些质量控制会贯穿CAR-T生产的各个阶段。
其中CAR-T的均一性和纯度主要指目标细胞(CAR阳性T细胞)所占的比例。目前有针对CAR不同结构区域的检测方法,包括针对CAR抗原结合位点的(如CD19抗原或抗scFv抗体),和针对轻链或铰链区的(如抗Fab抗体或Protein L)。
近岸蛋白提供CARTEST® Human CD19-PE Kit(Cat. No.:CT19P)可用于CAR阳性率检测。此方法利用抗原-抗体特异性反应,可有效降低使用Protein L检测ScFv存在假阳性率高的问题,使得数据更加真实可靠。
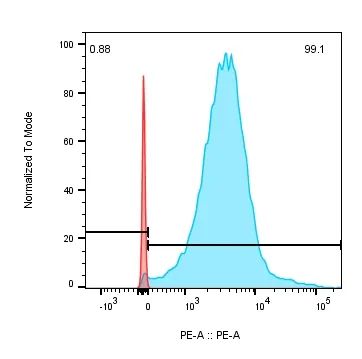
CARTEST®Human CD19-PE Kit detects the positive rate of anti-CD19 CAR-CHO cells.Add 5 µL of CD19-PE solution to a suspension of 5×105 cells to be tested, and incubate at 2-8°C in the dark for 30 minutes. Red indicates CAR-negative cell staining results with a false-positive rate of less than 0.5%; blue represents CD19-CAR-positive cell staining results showing a positivity rate of more than 98%.
此外,近岸蛋白还可以提供多种类型的CAR-T阳性率检测试剂盒和靶点抗原,可用于CAR-T阳性率检测。
CAR-T阳性率检测试剂盒:
| Cat. No. | Size | Product Name |
| CT19P | 25T/100T | CARTEST® Human CD19-PE Kit |
|
|
25T/100T | CARTEST® Human CD20-PE Kit |
| CTBCMA6 | 25T/100T | CARTEST® Human BCMA-647 Kit |
| CTBCMAA | 25T/100T | CARTEST® Human BCMA-APC Kit |
| CTBCMAP | 25T/100T | CARTEST® Human BCMA-PE Kit |
| CTMSLN6 | 25T/100T | CARTEST® Human MSLN-647 Kit |
| CTMSLNA | 25T/100T | CARTEST® Human MSLN-APC Kit |
| CTMSLNP | 25T/100T | CARTEST® Human MSLN-PE Kit |
CAR-T靶点抗原:
|
BCMA |
CD123 |
CD19 |
CD20 |
|
CD22 |
CD30 |
CD33 |
CD38 |
|
CD7 |
CD70 |
Claudin 18.2 |
GPC3 |
|
EGFR |
EGFR vIII |
EpCAM |
FOLR1 |
|
FAP |
HER2 |
MSLN |
MUC1 |
|
MUC16 |
NKG2D Ligands |
ROR1 |
PSMA |
陆 CAR-T细胞回输
最终,经质量监控合格达到足够数量的的CAR-T细胞,经过最后的末端工艺以及细胞冻存,即可回输病人体内。
以上便是常规CAR-T细胞产品的简易制备流程。无论使用何种制造模式,成功的CAR-T细胞生产依赖于整体流程的优化。其中所用原料/辅料的合规、高品质十分重要。近岸蛋白提供符合CAR-T临床制备需求的一系列GMP产品,包括GMP级重组CD3抗体/CD28抗体、GMP级CD3/CD28 beads、GMP级mRNA原料酶、GMP Cas9/AaCas12bMax/enCas12hf/enCas12Ultra蛋白、GMP级全能核酸酶、GMP级细胞因子(如IL-2/IL-7/IL-15)等,欢迎垂询!
参考文献
[1]NMPA官网
[2]恒润达生官微
[3] Kamilla Swiech, et al. Chimeric Antigen Receptor T Cells Development and Production.
[5] Li C, Mei H, Hu Y. Applications and explorations of CRISPR/Cas9 in CAR T-cell therapy. Brief Funct Genomics. 2020
[6] Mcclure C , Cole K , Wulff P , et al. Production and Titering of Recombinant Adeno-associated Viral Vectors[J]. J Vis Exp, 2011(57).
[7] Hopkins B, Fisher J, Chang M, Tang X, Du Z, Kelly WJ, Huang Z. An In-Vitro Study of the Expansion and Transcriptomics of CD4+ and CD8+ Naïve and Memory T Cells Stimulated by IL-2, IL-7 and IL-15. Cells. 2022
